Comment commander ?
Pour commander facilement et rapidement, vous pouvez soit :
- nous envoyer un email sur l’adresse : sales@gl-biocontrol.com,
- nous contacter par téléphone au +33 9 67 39 35 20,
- remplir ce formulaire.
Peut-on être livré le samedi ?
Les livraisons de produits en France métropolitaine sont possibles le samedi. Il vous suffit de le préciser sur votre commande. Pour les autres zones géographiques, nous contacter :
T. : + 33 (0)9 67 39 35 20
sales@gl-biocontrol.com
Comment payer ?
Le paiement doit être fait par chèque ou virement bancaire à l’ordre de “GL BIOCONTROL”. D’autres modes de paiement peuvent être envisagés mais nécessitent l’accord préalable de GL BIOCONTROL.
Que se passe-t-il si personne n’est disponible pour réceptionner un colis ?
Le transporteur déposera un avis de passage avec ses coordonnées. Le colis sera soit disponible dans l’agence du transporteur la plus proche le jour même ; soit reprogrammé en livraison le lendemain à la même adresse ou une adresse différente si la demande est faite.
Quel est le délai de livraison de nos produits ?
Nous nous efforçons de vous livrer au plus vite. En règle générale, le délai de livraison est de moins de 48h sur tout le territoire français.
Que faire en cas d'erreur de livraison ?
Les erreurs de livraison peuvent se porter sur la référence des produits ou leurs quantités. Nous vous invitons à prendre contact au plus tôt avec notre service client. En effet, si des produits doivent nous être retournés, vous bénéficiez d’un délai maximal de 8 jours ouvrables (hors produits à conserver au frais).
ÉTUDES
Pourquoi choisir GL BIOCONTROL pour réaliser vos Analyses Méthodiques des Risques ?
Notre bureau d’études GL BIOCONTROL se différencie des autres prestataires d’Analyses Méthodiques des Risques sur plusieurs points :
• Nous avons choisi d’utiliser la méthode AMDEC plutôt qu’HACCP dans nos Analyses Méthodiques des Risques car elle intègre en plus le facteur « détectabilité », particulièrement intéressant pour calculer l’Indice de Priorité du Risque Microbiologique et hiérarchiser les défauts relevés.
• Nous recherchons et évaluons les points critiques à partir d’une cartographie ATP et PCR, permettant de déterminer le risque réel.
• Nous réalisons un plan de l’installation de refroidissement.
• Nous évaluons la pertinence de la stratégie de traitement globale.
• Nous élaborons le plan de maintenance, le plan d’entretien et le plan de surveillance.
Enfin, nous vérifions la conformité du carnet sanitaire (procédures, attestations,…).
Quel est le délai d’intervention de GL BIOCONTROL sur votre installation ?
Notre délai d’intervention peut être du jour au lendemain dans la mesure où notre planning le permet. Dans le cas contraire, comptez en moyenne 4 jours. Quoi qu’il en soit, nous mettrons tout en oeuvre pour intervenir au plus vite.
Pourquoi GL BIOCONTROL ne réalise pas de contrôle réglementaire des installations de refroidissement ?
Les installations de refroidissement évaporatif par dispersion d’eau dans un flux d’air, généré par ventilation mécanique ou naturelle, appartiennent à la rubrique n°2921 des Installations Classées pour la Protection de l’Environnement (ICPE). Les arrêtés ministériels concernant ces installations ont évolué en décembre 2013.
Une des modifications concerne les contrôles réglementaires réalisés. Ces contrôles ont pour objectif de valider tout simplement le respect des arrêtés. Concernant les organismes compétents pour ces contrôles, rappelons que seule l’Inspection des Installations Classées (D.R.E.A.L.) est habilitée à contrôler les installations à enregistrement. Pour les autres types d’installations, le Ministère en charge des installations classées a établi une liste d’organismes agréés. GL BIOCONTROL n’a pas souhaité candidater. En effet, les contrôles réglementaires valident entre autres la pertinence du contenu de l’analyse méthodique des risques légionelles. Notre bureau d’études propose la réalisation de cette étude. Depuis la création de notre société, nous avons toujours refusé d’être juge et parti en contrôlant notre propre travail.
Quelle est la place de GL BIOCONTROL par rapport aux autres intervenants sur une installation ?
La société GL BIOCONTROL propose ses produits et ses prestations de service à l’ensemble des intervenants autour des installations d’eaux : services de l’État, aux laboratoires de contrôle, aux sociétés de maintenance, aux bureaux d’études, aux traiteurs d’eau, aux industriels…
Lorsque nous intervenons auprès des industriels, notre rôle se situe en tant qu’interface entre l’industriel et son traiteur d’eau, son bureau d’études ou sa société de maintenance. Parallèlement à ses activités de vente de produits et prestations de service, nous travaillons avec plusieurs partenaires de développement afin d’optimiser ces produits et prestations de service.
Pourquoi indiquons-nous que notre Analyse Méthodique des Risques est “Évolutive” ?
Une Analyse Méthodique des Risques (AMR) dite “Classique” va étudier les risques potentiels de développement microbiologique. Notre bureau d’études a fait le choix d’étudier les risques effectifs de développement microbiologique par la mise en oeuvre de mesures in-situ et en laboratoire. C’est la raison pour laquelle cette AMR est dite “Évolutive”. Ceci a pour objectif de vous faire gagner du temps et de l’argent dans les éventuelles actions préventives et correctives à mettre en place.
GÉNÉRALITÉS SUR L’ATP ET L’ATP-METRIE
Qu’est-ce que l’ATP ?
L’adénosine triphosphate (ATP) est une molécule présente chez tous les organismes vivants pour fournir de l’énergie aux réactions chimiques. L’ATP est spécifique des milieux vivants. On considère que toute trace d’ATP est le témoin d’une trace de vie.
Quels microorganismes sont lysés par le réactif DENDRIDIAG® ?
Les kits DENDRIDIAG® lysent préférentiellement les bactéries, les cyanobactéries ainsi que les amibes non-enkystées. Pour une lyse totale de tous les microorganismes (moisissures, levures, amibes enkystées et algues) consulter GL BIOCONTROL.
Comment et combien de temps conserver les consommables plastiques ?
Les consommables plastiques doivent être conservés dans un endroit sec à température ambiante. Leur date limite d’utilisation est affichée sur leur emballage individuel.
Qu’est-ce que je mesure avec l’ATP-métrie ?
Mesurer une quantité d’ATP revient à mesurer la quantité totale de microorganismes présents dans l’échantillon. L’ATP-métrie est une technique de biologie moléculaire, basée sur le principe de la bioluminescence. La mesure s’effectue à l’aide d’un luminomètre.
A quelle température dois-je utiliser les réactifs ?
Pour assurer une efficacité enzymatique optimale, les réactifs doivent être à température ambiante (18°C – 25°C).
J’ai oublié le kit DENDRIDIAG® à température ambiante. Que faire ?
Depuis 2020, les kits IW, SW et BF peuvent être conservés à température ambiante pendant 3 mois, et 1 an au réfrigérateur. Les kits UPW et AIR doivent être stockés au congélateur (-18°C). Si vous avez oublié les réactifs à température ambiante et que vous souhaitez vérifier leur efficacité, vous pouvez effectuer un contrôle. Pour ce faire, reportez-vous au paragraphe ‘Contrôle de l’efficacité des réactifs’ dans le livret d’utilisation.
Qu’est-ce que je mesure avec le kit d’ATP-métrie DENDRIDIAG® ?
Grâce au kit DENDRIDIAG® et à la filtration, seul l’ATP intracellulaire est mesuré. Il s’agit de l’ATP présent à l’intérieur des cellules vivantes représentant les bactéries en bon état.
Il existe aussi l’ATP extracellulaire qui est présent à l’état libre dans l’échantillon. Il est issu des microorganismes « morts » ou en phase de lyse. La filtration permet d’éliminer cet ATP. Sans étape de filtration, c’est l’ATP total qui est mesuré : ATP intracellulaire + extracellulaire.
Comment et combien de temps conserver les réactifs ?
Les réactifs d’ATP-métrie IW, SW et BF peuvent être conservés 3 mois à température ambiante ou 1 an au réfrigérateur.
Les kits UPW et AIR doivent être stockés au congélateur (-18°C) et à l’abri de la lumière. Ils peuvent ainsi être conservés 12 mois a minima. Suite à leur première utilisation, ces réactifs seront préférentiellement recongelés, ou à défaut conservés au réfrigérateur (3 – 8°C) et à l’abri de la lumière jusqu’à 8 semaines.
Dans quels domaines d’application puis-je utiliser les kits DENDRIDIAG® ?
Eau industrielle : installations de refroidissement (tours aéroréfrigérantes), circuits de process, unités de production d’eau à usage industriel…
Eau sanitaire : réseaux d’adduction d’eau potable, réseau de distribution d’eau de consommation humaine, réseaux d’eau à usage sanitaire (eau chaude & froide), réseaux d’eau thermale des établissements de soins et de remise en forme…
Eau ultra-pure : boucles à usage médical, pharmaceutique, dialyse, micro-électronique, réseaux d’eau bactériologiquement maitrisée…
Surface : piscines,process alimentaires, circuits de refroidissement, unités de production d’eau sanitaire…
Air : circuit aérauliques, hôpitaux, bureaux, industries à risques comme les usines de compostage, méthanisation, élevage…
LES KITS DENDRIDIAG® IW, SW ET UPW
Quel volume d’échantillon dois-je filtrer ?
Par défaut, nous vous conseillons de filtrer un volume de :
- 10 ml pour le kit IW,
- 50 ml pour le kit SW,
- 1 000 ml pour le kit UPW.
La filtration d’un volume représentatif offre une meilleure fiabilité des résultats en concentrant les microorganismes sur une membrane de porosité 0,45 µm. Aussi, grâce à la filtration, seul l’ATP intracellulaire est mesuré.
Veillez à toujours noter le volume que vous filtrez pour chaque échantillon.
Je n’arrive pas à filtrer la totalité de mon échantillon.
Si l’eau est très chargée en bactéries et particules, il se peut que le filtre se colmate et que la filtration de l’échantillon ne soit pas possible dans sa totalité.
- Si vous êtes parvenu à filtrer une partie de l’échantillon (au moins 10%) : notez le volume filtré, dévissez le filtre et vider la seringue. Replace le piston à 3 ml si vous utilisez une seringue de 10 ml ou à 10 ml si vous utilisez une seringue de 50 ml. Revisser le filtre sur la seringue et continuez le protocole normal.
- Si vous ne parvenez pas à filtrer : diluez votre échantillon, soit en ne mettant que 1 ml dans la seringue et en complétant jusqu’à 10 ml avec de l’eau stérile si vous utilisez une seringue de 10 ml, soit en versant 5 ml d’échantillon et en complétant jusqu’à 50 ml si vous utilisez une seringue de 50 ml.
Pour plus d’information, consultez GL BIOCONTROL.
Quelles limites de référence dois-je prendre en compte pour mes analyses sur l’eau ?
A partir de notre retour d’expérience, nous avons établi les limites de surveillance et de contrôle suivantes :
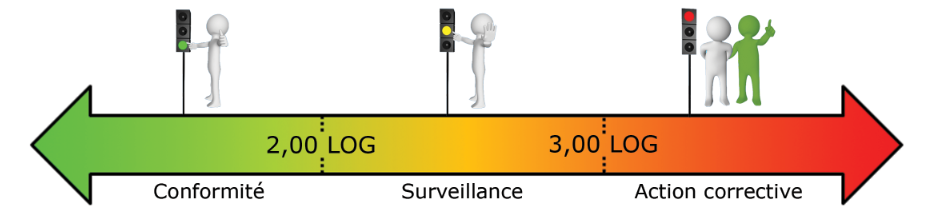
- Réseau de production d’eau potable – Sortie filière (en LOG eq.bact./ml) :
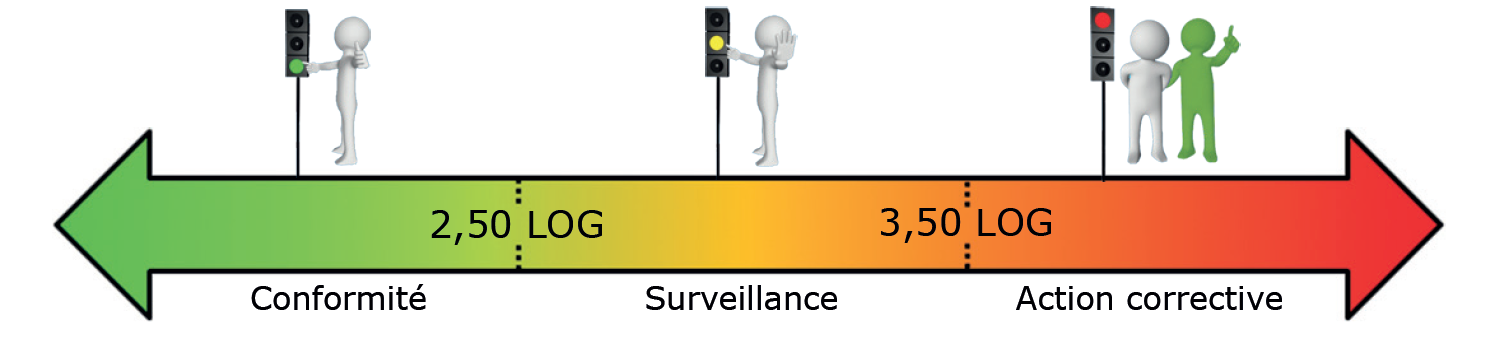
- Réseau de distribution d’eau potable (en LOG eq.bact./ml) :
- Réseaux intérieurs – Eau chaude sanitaire – Eau d’appoint du circuit industriel (en LOG eq.bact./ml) :
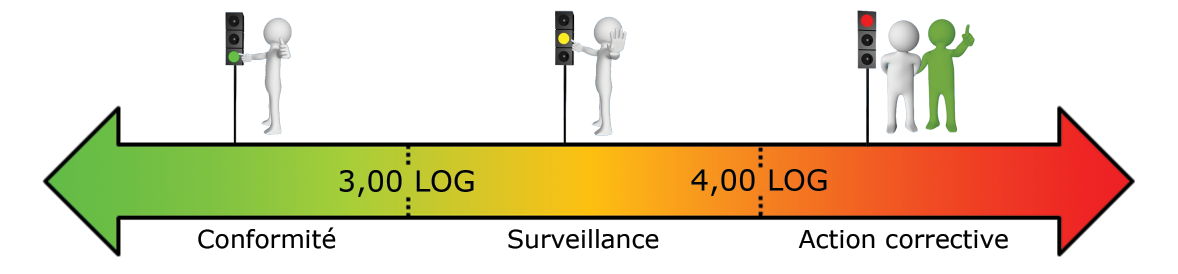
- Eau du circuit industriel – Eau de TAR (en LOG eq.bact./ml) :
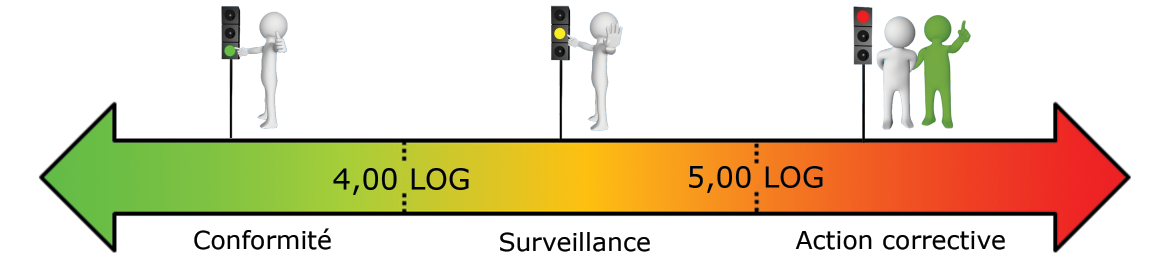
Ces seuils doivent être ajustés pour chaque installation car chaque écosystème rencontré est différent.
Je n’arrive pas à faire sortir la mousse.
Après aspiration du réactif, il est important de repousser la totalité du liquide dans le tube jusqu’à l’apparition d’une mousse. Pour faire sortir la mousse facilement sur une seringue de 50 ml, vous devez appliquer une pression forte et constante de quelques secondes en appuyant sur le piston avec la paume de la main.
Toutefois, si vous continuez à rencontrer des difficultés, nous pouvons vous fournir des seringues de 10 ml pour faciliter la manipulation.
Quelle unité utiliser pour exprimer mes résultats ?
Le picogramme d’ATP par millilitre (pgATP/ml) est l’unité vraie.
Pour une meilleure compréhension du résultat, il est possible d’utiliser l’équivalent bactérie par millilitre (eq.bact./ml) en se basant sur la convention : 1 pgATP ≈ 1 000 bactéries. Ce résultat n’est pas strictement vrai, il s’agit d’une moyenne car la quantité d’ATP varie d’un microorganisme à l’autre et selon la phase de croissance (métabolisme actif ou dormance).
Pourquoi mon résultat R2 est inférieur au résultat R1 ?
La perte du signal est de 6 à 8% par minute. Si le temps de manipulation est trop important entre l’extraction et l’obtention du résultat R2, l’ajout dosé se fera sur la phase de décroissance du signal. Ce phénomène peut être observé sur des quantités d’ATP très importante. Nous vous conseillons de recommencer l’analyse en filtrant un volume d’eau plus faible (de moitié a minima).
J’ai trop de mousse dans le tube.
Afin de récupérer l’ensemble des bactéries de l’échantillon, il est nécessaire de repousser la totalité du liquide dans le tube jusqu’à l’apparition d’une mousse. Toutefois, la pression sur le piston doit être stoppée dès que la mousse apparaît afin d’éviter de former une barrière dans le haut du tube de mesure.
Si vous avez un excédent de mousse ou une bulle qui se forme dans la partie supérieure du tube, tapoter la base du tube sur une surface plane.
Pourquoi exprimer mes résultats en LOG ?
Exprimer un résultat en LOG permet de savoir si deux valeurs sont significativement différentes. On considère deux résultats différents lorsqu’on mesure 1 LOG d’écart entre les deux valeurs.
L’écriture LOG du résultat en équivalent bactérie par millilitre permet de simplifier le résultat afin de mieux l’interpréter. La correspondance mathématique de l’unité eq.bact./ml au LOG est la suivante :
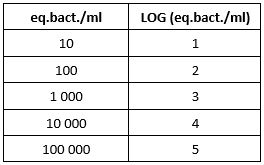
Le tableur Excel et l’application DENDRIDIAG®SOFTWARE vous donnent automatiquement cette valeur en LOG.
LE KIT DENDRIDIAG® BF
Quelle surface dois-je prélever ?
Nous vous fournissons un gabarit de prélèvement qui délimite une surface de 20 cm². Ce gabarit permet d’avoir un prélèvement significatif de la surface étudiée ce qui offre une bonne fiabilité des résultats. Néanmoins, si vous souhaitez augmenter la sensibilité de la mesure, vous pouvez réaliser deux prélèvements de la même surface en déplaçant le gabarit. Pensez à noter la surface prélevée.
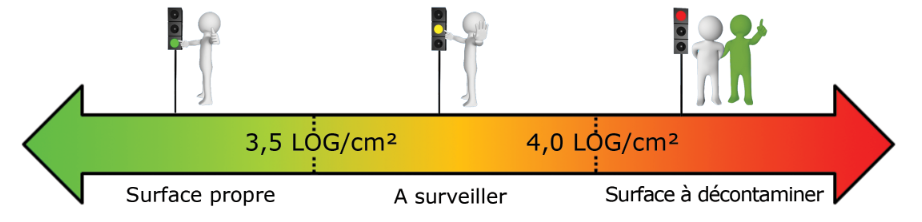
Quelles limites de référence dois-je prendre en compte pour mes analyses sur les surfaces ?
A partir de notre retour d’expérience, nous avons établi les limites de surveillance et de contrôle suivantes :
- Ouverture bassin piscine (en LOG/cm²) :
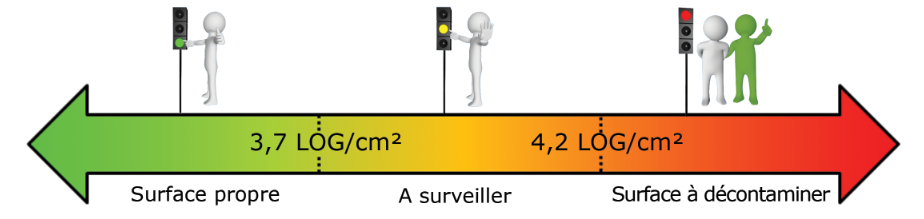
- Piscine en cours d’exploitation (en LOG/cm²) :
- Surface en production agroalimentaire (en pgATP/cm²) :
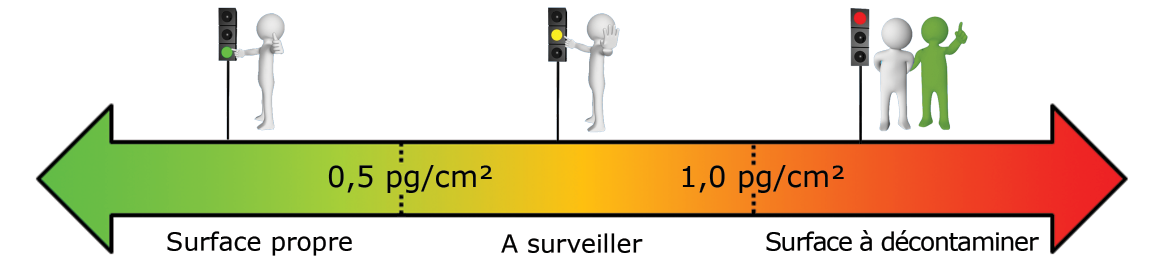
- Surface d’une canalisation d’un circuit d’eau (en pgATP/cm²) :
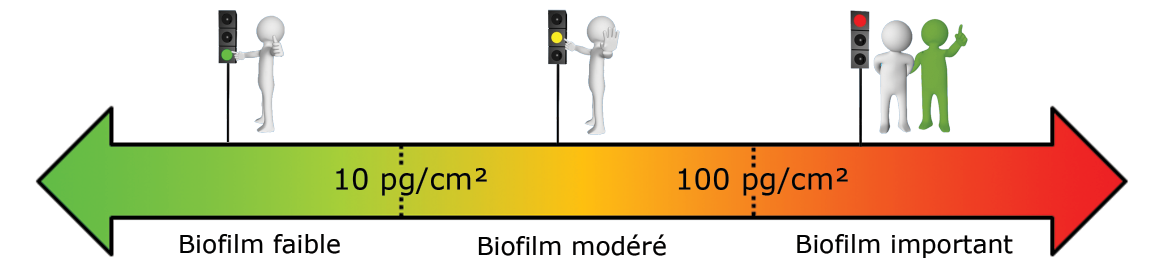
Ces seuils doivent être ajustés pour chaque installation car chaque écosystème rencontré est différent.
Quelle unité utiliser pour exprimer mes résultats ?
Le picogramme d’ATP par centimètre carré (pgATP/cm²) est l’unité vraie.
Pour une meilleure compréhension du résultat, il est possible d’utiliser l’équivalent bactérie par centimètre carré (eq.bact./cm²) en se basant sur la convention : 1 pgATP ≈ 1 000 bactéries. Ce résultat n’est pas strictement vrai, il s’agit d’une moyenne car la quantité d’ATP varie d’un microorganisme à l’autre et selon la phase de croissance (métabolisme actif ou dormance).
Pourquoi exprimer mes résultats en LOG ?
Exprimer un résultat en LOG permet de savoir si deux valeurs sont significativement différentes. On considère deux résultats différents lorsqu’on mesure 1 LOG d’écart entre les deux valeurs.
L’écriture LOG du résultat en équivalent bactérie par centimètre carré permet de simplifier le résultat afin de mieux l’interpréter. La correspondance mathématique de l’unité eq.bact./cm² au LOG est la suivante :
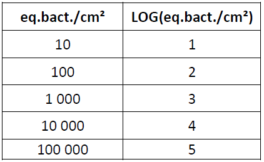
Le tableur Excel vous donne automatiquement cette valeur en LOG.
LUMINOMÈTRE
Mon porte-tube compatible PD30/SMART est sale. Comment le nettoyer ?
Il arrive qu’un excédent de mousse ou une bulle dans le haut du tube de mesure salisse le porte-tube. Dans ce cas-là, vous pouvez le nettoyer avec un papier absorbant imbibé d’eau ou d’Ethanol 70%.
Le luminomètre C110 affiche « OVERSCALE ».
Le luminomètre C110 étant très sensible, il peut arriver qu’il affiche le message « OVERSCALE » sur certains échantillons. Cela signifie que la limite supérieure de linéarité de l’appareil a été dépassée. En d’autres termes, l’échantillon est fortement contaminé. Si vous effectuez vos analyses sur une matrice liquide, recommencez la manipulation en filtrant 1/10ème du volume.
J’ai oublié de noter les mesures R1 et R2.
Il est possible de récupérer les résultats RLU dans le luminomètre. Pour cela, une fois le luminomètre correctement allumé, appuyez sur la flèche du haut pour remonter aux dernières valeurs obtenues.
Le luminomètre PD30 ou SMART sonne et ne fait pas la calibration.
La calibration de l’appareil ne peut se faire que si le luminomètre est vide et le capot correctement fermé. Si le luminomètre PD30 ou SMART sonne et ne fait pas la calibration, vérifiez que nous n’avez pas laissé le porte-tube à l’intérieur et que le capot est bien fermé.