Le Plan de Gestion de Sécurité Sanitaire de l’Eau (PGSSE) adopte une approche globale pour assurer en permanence la qualité de l’approvisionnement en eau potable. C’est un changement de paradigme majeur car il demande de passer d’une approche curative à une approche préventive.
Le PGSSE doit permettre :
- D’identifier les dangers et d’évaluer les risques sanitaires des installations de production et distribution d’eau potable (de la ressource au robinet du consommateur) ;
- De déployer des moyens de terrain pour maîtriser ces risques ;
- D’assurer l’efficacité des mesures en place, et de contribuer à la préservation de la santé du consommateur.

Améliorer la gestion du risque microbiologique par une stratégie axée sur la prévention et la réactivité
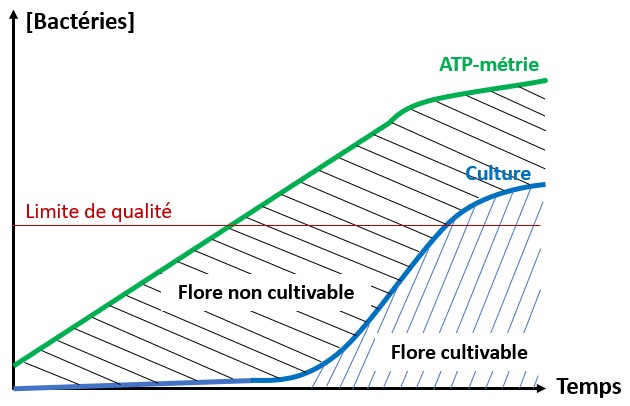
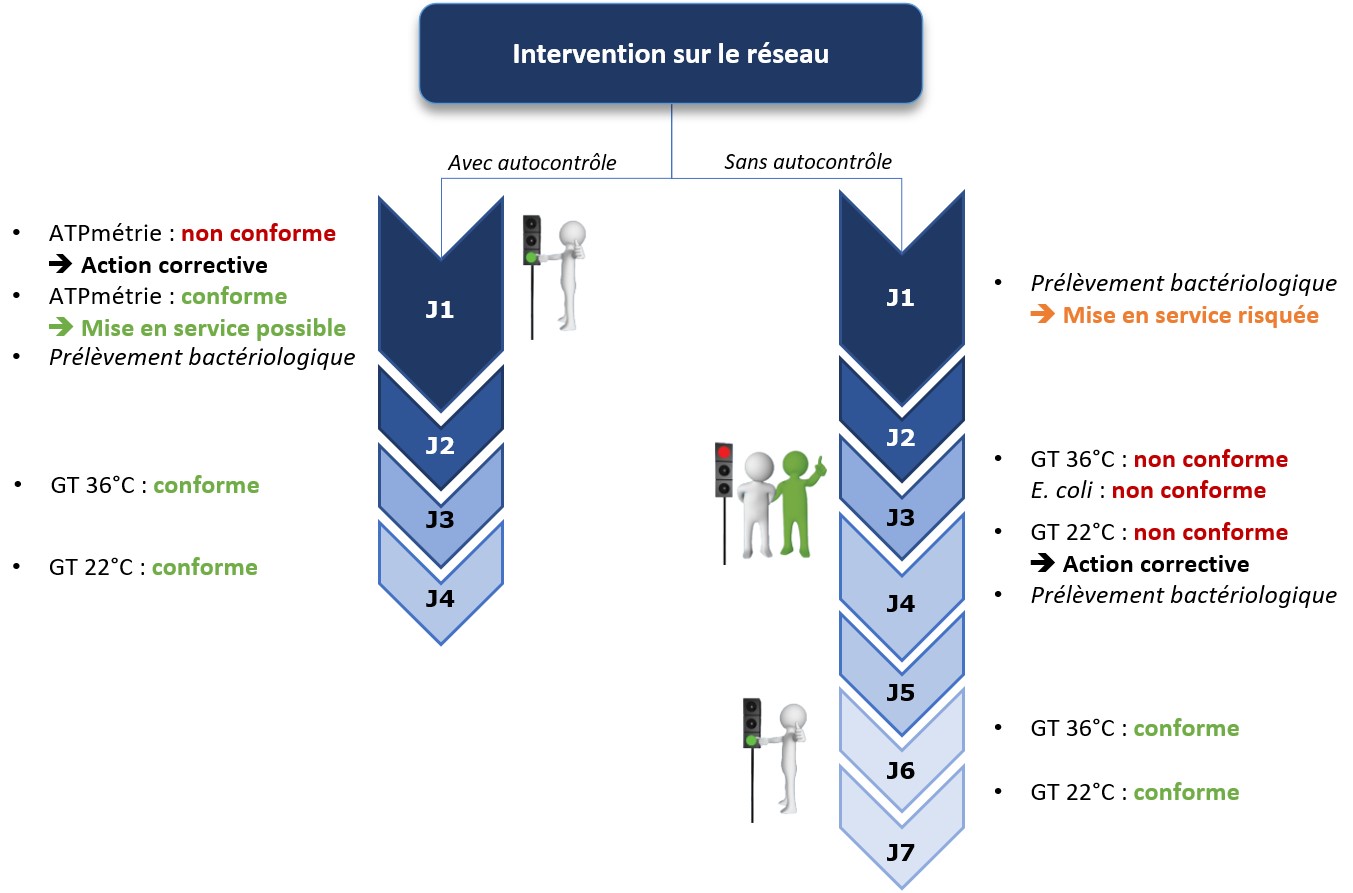
Le risque microbiologique est considéré comme majeur car il est de nature aiguë et peut très rapidement entraîner des crises sanitaires graves. Actuellement, la gestion de ce risque repose principalement sur des méthodes traditionnelles de culture. Cependant, celles-ci sont trop limitées en termes de réactivité en raison des délais d’obtention des résultats, rendant difficile le pilotage des installations. Cet aspect est clairement mis en évidence dans le chapitre 1, page 12, du guide de l’ASTEE (voir schéma ci-dessous).
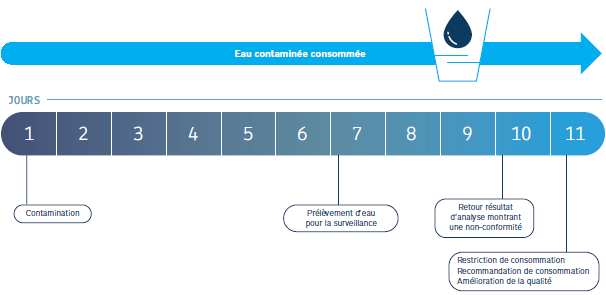
Figure 1 – Quelques limites de la surveillance, d’après R. McKeown et D. Maison
(Initier, mettre en place, faire vivre un PGSSE – Chapitre 1 – Généralités)
Ce schéma illustre le fait qu’une restriction de consommation peut être imposée plusieurs jours après la contamination. De ce fait, une eau potentiellement contaminée est consommée pendant cette période de latence. Cet exemple confirme qu’il est essentiel de disposer d’outils offrant une réponse immédiate pour piloter son réseau et assurer en permanence la qualité de l’eau potable.
Par ailleurs, l’ARS rappelle que le contrôle sanitaire est là pour vérifier la conformité de l’EDCH et ne doit pas être considéré comme un outil de pilotage de gestion du risque.
Dans ce contexte, l’ATP-métrie, en combinaison avec des mesures physico-chimiques et l’application Lumen, offre une solution complète répondant aux exigences du PGSSE. L’ATP-métrie est une analyse de terrain, simple, rapide et fiable, donnant une mesure objective et en temps réel de la qualité microbiologique de l’eau. A ses côtés, l’application Lumen est un véritable outil de gestion, gratuitement mis à disposition des utilisateurs de l’ATP-métrie DENDRIDIAG.
Il permet :
- le regroupement des données d’ATP-métrie et de physico-chimie en une seule application,
- l’interprétation combinée de ces données,
- la consultation en temps réel de toutes les informations par les PRPDE et autres collaborateurs,
- l’édition et l’envoi de rapport de façon instantanée,
- la visualisation graphique (biosurveillance, cartographie…)
L’association de l’ATP-métrie avec des analyses physicochimiques et des outils de gestion offre aux opérateurs une solution complète pour assurer la sécurité sanitaire de l’eau potable et prévenir les risques pour la santé publique. Elle permet d’aider à la prise de décision ou à la levée de doute, et facilite la mise en place de mesures correctives appropriées.
Cet outil d’autosurveillance est le parfait complément des mesures obligatoires du contrôle sanitaire.
Comment l’ATP-métrie s’intègre aux Plans de Surveillance ?
Un outil polyvalent pour la gestion en routine du réseau
Utilisée en autosurveillance, l’ATP-métrie permet une approche proactive préconisée par les plans de surveillance du PGSSE. Les opérateurs terrain peuvent par exemple :
- évaluer l’efficacité des procédures de nettoyage et de désinfection des différents ouvrages,
- détecter précocement des anomalies microbiologiques,
- identifier les zones à risque (proche hôpitaux, rachat d’eau, interconnexions…),
- réagir immédiatement en cas de dérive,
- mettre en place les mesures préventives et correctives appropriées dans les plus brefs délais.
De plus, très souvent, il est difficile d’attendre les résultats des méthodes culturales. C’est par exemple le cas lors de la remise en service d’ouvrages. Que ce soit après un lavage de réservoirs, une réparation sur le réseau, le pilotage des changement de ressource ou de citernage, il est primordial d’évaluer immédiatement l’efficacité de l’intervention. L’ATP-métrie permet de sécuriser au maximum la remise en service et d’éviter les retours de chantier onéreux et chronophages.
Cette approche préventive réduit les risques de distribution et de consommation d’eau contaminée.
Des retours d’expérience de collectivités et délégataires :
- Suivi de la filière de production d’eau potable (Régie des Eaux de Montpellier Méditerranée Métropole)
- Intervention réseau – Désinfection de canalisations neuves (SUEZ Nouvelle-Aquitaine)
- Gestion de crise – Analyse bactériologique non conforme (3CMA)
- Réclamation clients (Acqua Publica)
- Remplacement de l’analyse D1 en autocontrôle par l’ATP-métrie (Acqua Publica)
- Webinaire – Retours d’expérience : l’ATP-métrie pour la gestion de l’eau potable
Un outil indispensable en cas de crise
La gestion de crise implique une grande réactivité face au risque microbiologique. Il est essentiel de pouvoir très rapidement lever les doutes quant à l’intrusion de bactéries dans le réseau d’eau potable, que ce soit lors :
- d’événements climatiques (sécheresse, inondation)
- de pannes électriques,
- de casses réseau,
- de malveillances,
- de réclamations clients,
- de plan ORSEC – eau potable.
L’ATP-métrie se révèle être un atout majeur dans ces situations de crise de par sa réactivité et son flexibilité. En tant qu’outil de terrain, il est simple à utiliser, ne requiert aucune source d’énergie et utilise des réactifs stables. De plus, il ne nécessite pas de connaissances techniques avancées, ce qui le rend facilement déployable dans des conditions exceptionnelles.
Cet outil permet dans un premier temps d’évaluer immédiatement le niveau de risque et de piloter la prise rapide de décision, puis, dans un second temps de contrôler l’impact des actions correctives mises en place.
L’ATP-métrie DENDRIDIAG a déjà fait ses preuves en tant qu’outil de gestion de crise lors de la sécheresse de l’été 2022. Découvrez les retours d’expérience en vidéo.
Comment l’ATP-métrie réduit le risque résiduel de l’analyse des dangers ?
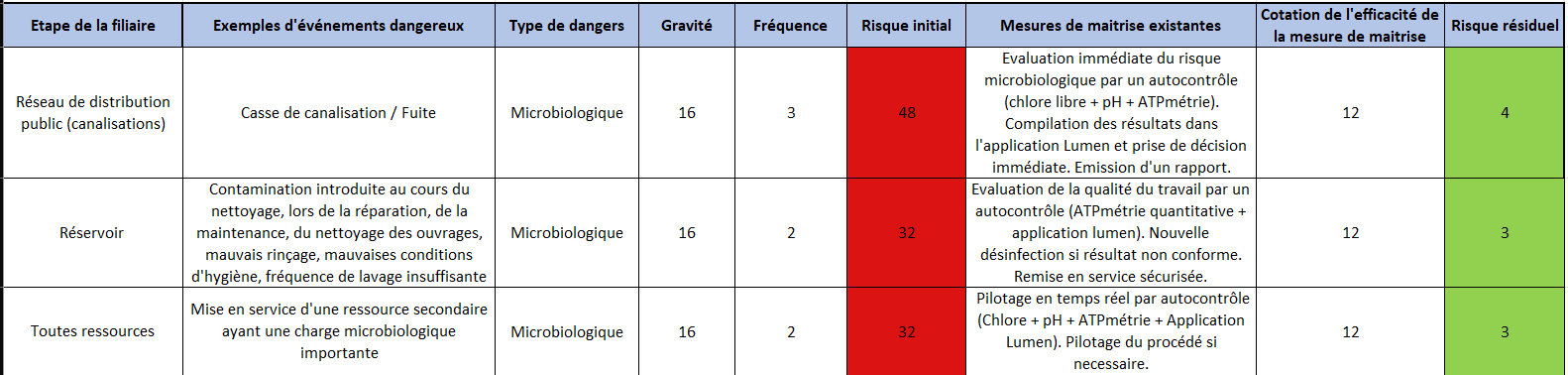
Le PGSSE demande de réaliser une étude de dangers sur l’ensemble du système de production et de distribution de l’eau. Dans un premier temps, le risque initial est calculé. Il correspond au risque intrinsèque, inhérent à l’installation et tient compte de la gravité et de la fréquence du danger.

Figure 2 – Calcul du risque initial
(Initier, mettre en place, faire vivre un PGSSE – Chapitre 3 – Page 62)
La cotation de ce risque donne lieu à une classification du risque (faible, moyen ou important). Dès lors que ce risque initial est jugé moyen ou important, il est indispensable de le gérer.
Comme mentionné précédemment, le risque microbiologique est considéré comme aigu, ce qui entraîne automatiquement une cotation de gravité du danger à 16. Cela signifie qu’il présente un risque initial important, quelle que soit sa fréquence. De plus, c’est un risque omniprésent dans le domaine de l’EDCH.
Pour prévenir ou éliminer ce danger, des mesures de maîtrise sont mises en place. Elles sont prises en compte pour qualifier la gravité réelle de ce risque, et ainsi calculer le “risque résiduel”.

Figure 3 – Calcul du risque résiduel
(Initier, mettre en place, faire vivre un PGSSE – Chapitre 3 – Page 65)
Dans cette approche, l’ATP-métrie couplée à l’application Lumen fait grandement chuter ce risque résiduel en permettant :
- soit de rendre compte du risque microbiologique immédiatement,
- soit d’évaluer l’efficacité des contre-mesures.
En voici un exemple :
Tableau 1 – Intégration de l’ATP-métrie dans l’évaluation des dangers