GL Biocontrol rejoint LuminUltra et élargit son champ d’action dans le suivi microbiologique de l’eau en France et en Europe
Montpellier, France – 16 septembre 2025
GL Biocontrol, acteur de référence en France dans le diagnostic microbiologique de l’eau, rejoint officiellement LuminUltra, fournisseur mondial de solutions de biologie moléculaire appliquée, basé au Canada. L’acquisition, finalisée le 1er janvier 2025, fait de la France le siège européen de LuminUltra.
Fondée et implantée à Montpellier, GL Biocontrol a contribué à transformer le suivi microbiologique de l’eau en France, avec les tests ATP de 2nde génération désormais utilisés par plus de 500 collectivités et de nombreux acteurs industriels. L’entreprise s’est imposée comme un partenaire clé pour les exploitants de réseaux d’eau potable, de tours de refroidissement et d’eau industrielle – en fournissant des outils d’analyse rapides et fiables, ainsi qu’un accompagnement personnalisé permettant de transformer chaque résultat en décision claire et opérationnelle.

Des approches combinées pour un contrôle microbiologique renforcé
Avec plus de 30 ans d’expérience dans le suivi microbiologique de l’eau, de l’énergie et de l’agroalimentaire, et une présence commerciale dans plus de 80 pays, LuminUltra est reconnu pour sa large gamme de solutions, qui permettent aux clients du monde entier de gérer les risques microbiologiques avec rapidité, clarté et confiance.
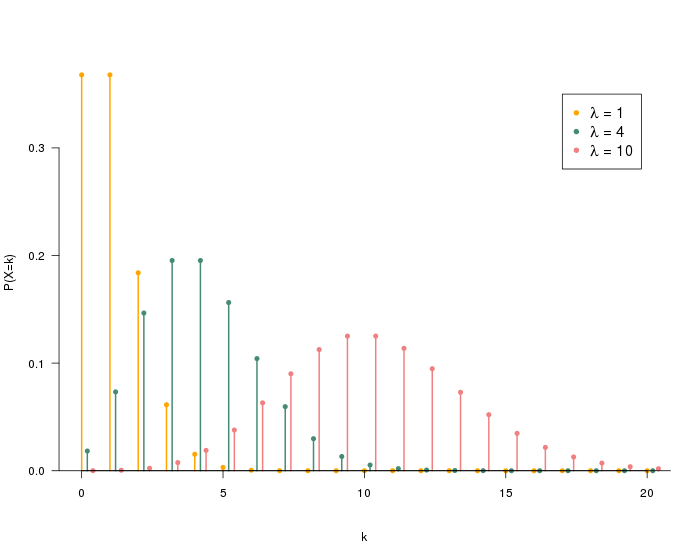
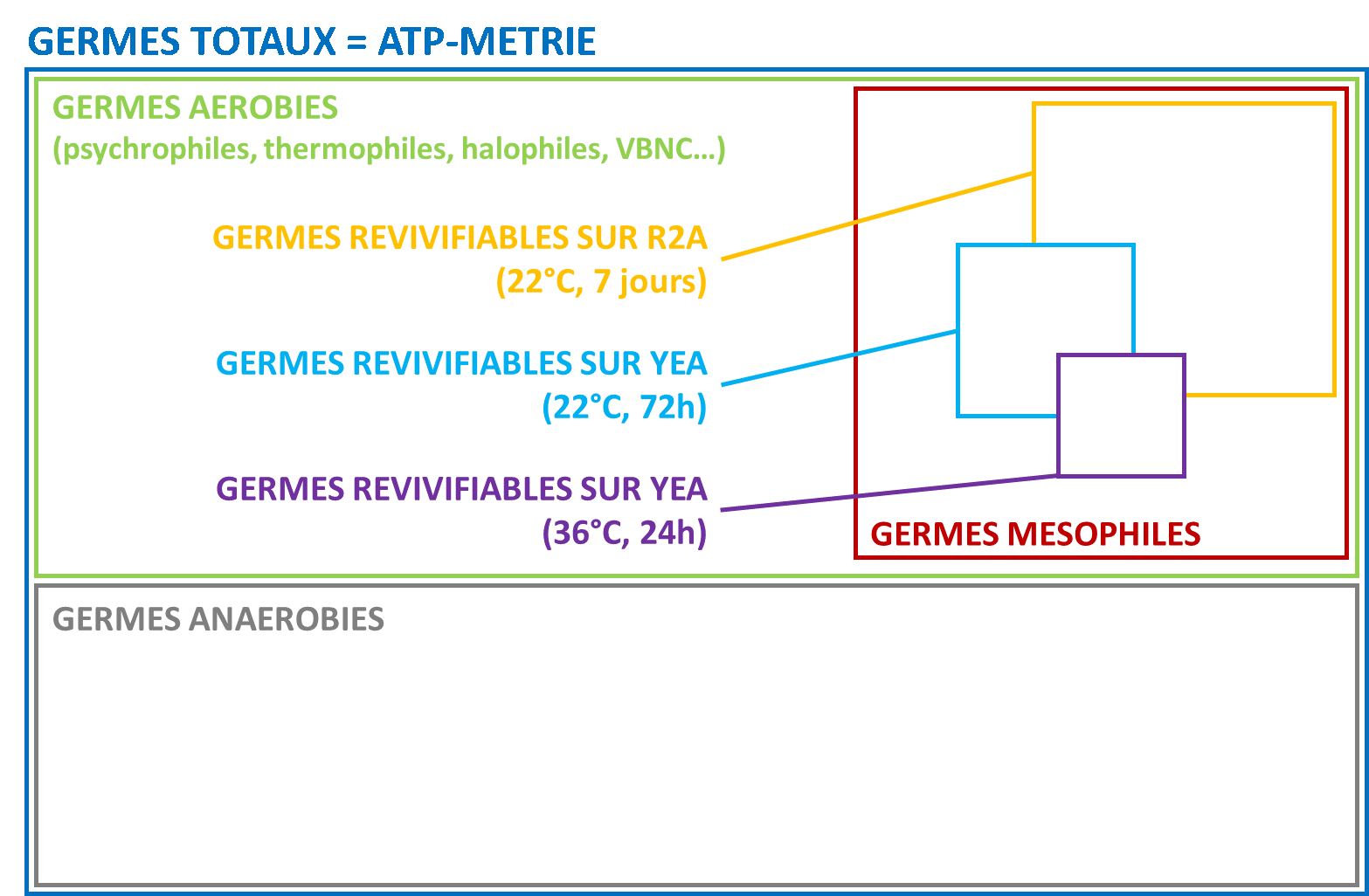
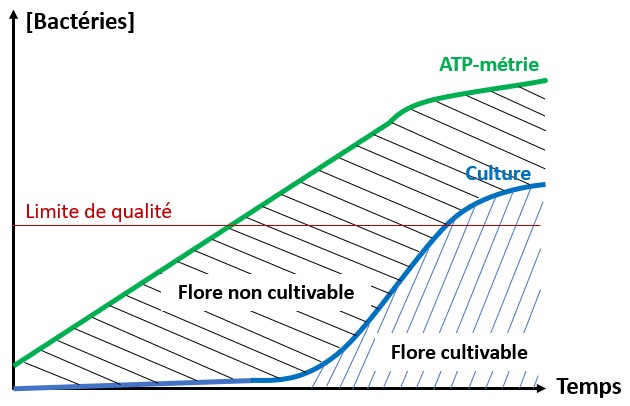
Son portefeuille inclut notamment les outils moléculaires GeneCount® pour le suivi par qPCR et NGS, ainsi qu’une gamme croissante de services de laboratoire et de plateformes numériques. L’ATP-métrie apporte une vision globale de la microbiologie de l’eau, tandis que la qPCR et le NGS offrent une analyse ciblée. Ces outils complémentaires renforcent l’expertise apportée aux clients, en leur permettant notamment d’identifier spécifiquement les bactéries indésirables, comme Legionella ou les microorganismes responsables de la corrosion ou de la nitrification. Cet arsenal technique permet de relever les défis microbiologiques les plus complexes.
Une mission commune, au service de la qualité de l’eau
« GL Biocontrol et LuminUltra sont unis par une mission commune : aider les industries et les collectivités à sécuriser leurs activités en leur donnant une vision claire et un contrôle accru des risques microbiologiques », souligne Pat Whalen, Président et CEO de LuminUltra. « La France est depuis longtemps un leader mondial en matière de qualité de l’eau. Ce partenariat nous permet de renforcer ce leadership tout en amplifiant la portée et l’impact du travail essentiel déjà accompli par GLB. »
GL Biocontrol poursuivra ses activités sous son nom actuel, et l’équipe, récemment renforcée, reste en place. Les clients continueront de bénéficier du même niveau d’excellence de service, désormais soutenue par l’envergure internationale de LuminUltra. Cette intégration ouvre également de nouvelles perspectives de croissance en France et en Europe, grâce à davantage de solutions, de formations et d’accompagnement pour les acteurs de l’eau.
A propos de GL Biocontrol
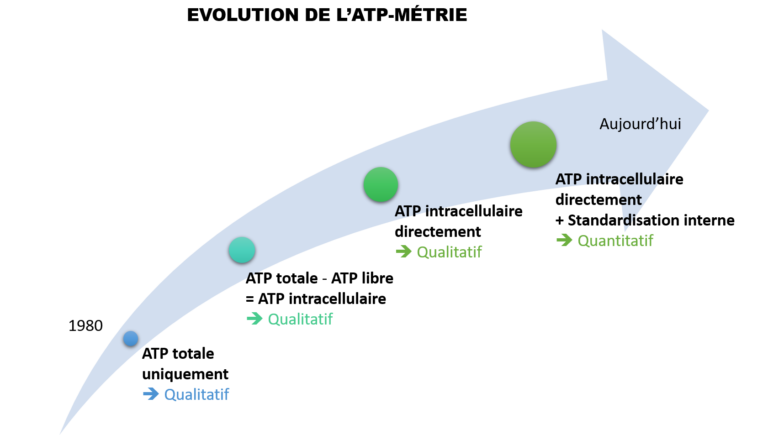
Depuis plus de 15 ans, GL Biocontrol met son expertise en microbiologie de l’eau au service des acteurs de la filière. Avec sa gamme de kits DENDRIDIAG®, l’entreprise fournit des solutions de terrain basées sur l’ATP-métrie, capables de détecter en moins de deux minutes un risque sanitaire sur tout type de réseaux : potable, industriel, eau chaude sanitaire ou de process.
Plus qu’un fournisseur de kits, GL Biocontrol accompagne ses clients dans la maîtrise du risque microbiologique à travers une aide à l’interprétation des résultats, des formations et des expertises sur site, faisant de lui un partenaire de confiance pour la biosurveillance et la gestion durable des risques.
A propos de LuminUltra
LuminUltra est un leader mondial du diagnostic moléculaire appliqué, à l’intersection des secteurs de l’alimentation, de l’énergie et de l’eau. Ses outils d’analyse, ses services et son expertise scientifique aident les industriels à transformer l’incertitude microbiologique en décisions claires et efficaces.
Fondée en 1995 et basée au Canada, LuminUltra accompagne des clients dans plus de 80 pays. Soutenue par XPV Water Partners, l’entreprise accélère sa croissance mondiale par l’innovation, des acquisitions stratégiques et un engagement constant : garantir la fiabilité de chaque mesure.