Grande consommatrice d’eau, l’industrie du papier a su s’adapter en réutilisant ses eaux industrielles. Cependant, elle fait face à des problèmes microbiologiques importants ayant plusieurs conséquences directes ou indirectes : qualité du produit fini, sécurité microbiologique du produit, soucis environnementaux, sécurité du personnel…
Comment faire face à ces problèmes ? Quelles solutions s’offrent à l’industrie papetière ?

Les problèmes rencontrés par l’industrie papetière
L’industrie du papier est une grande consommatrice d’eau. La quantité d’eau nécessaire pour fabriquer 1 kg de papier est estimée à 500 litres [1]. Dans un souci environnemental, tant face à la raréfaction de la ressource que pour mieux maîtriser ses rejets, l’industrie papetière a dû s’adapter. Aujourd’hui, 95% à 98% de l’eau utilisée en papeterie sont recyclées en interne [2]. Cependant, le bouclage des circuits accentue les problèmes microbiologiques.
En effet, les microorganismes tels que les bactéries, levures ou champignons, trouvent dans le processus papetier un terrain idéal pour se développer très rapidement. Les nombreux types de substances nutritives, les MES, la température allant de 30 à 60°C, le pH neutre (6,5 à 7,5) et autres, sont autant de facteurs favorables au développement microbien.
Or, lorsque les micro-organismes se développent de manière incontrôlée, ils forment des biofilms (ou slime) qui adhèrent aux machines. Ce biofilm s’accumule et est relargué dans le produit causant de nombreux effets néfastes :
- Affaiblissement de la feuille de papier induisant des cassures : les slimes tombent dans la bande de papier, laissant des trous après le processus de séchage. Cette pollution diminue la solidité du papier et conduit à des cassures, ainsi qu’à des temps d’arrêt coûteux.
- Tâche ou coloration indésirable de la pâte : suivant les microorganismes présents, des tâches grises, jaunes ou oranges par exemple vont apparaitre sur le papier. Ces défauts diminuent la valeur du produit, et peuvent même le rendre invendable.
- Mauvaises odeurs : les microorganismes produisent des gaz nauséabonds entraînant des problèmes de bien-être au travail, de santé et de plaintes du voisinage.
- Corrosion microbiologique : le développement de bactéries corrosives (bactéries sulfito-réductrices par exemple) endommagent les réseaux et induisent des coûts importants de maintenance.
Des solutions curatives en place
Pour prévenir et/ou remédier à ces problèmes, les exploitants de process papetier ont recours à de lourds traitements ayant des répercussions importantes sur l’environnement. Les deux principaux moyens d’actions curatifs sont :
- le nettoyage des circuits grâce à des produits biodispersants suivi d’une vidange total du réseau,
- la désinfection avec des produits biocides souvent néfastes pour l’environnement.
| Méthode d’action | Conséquences |
| Nettoyage | Déversement de bactéries filamenteuses dans les stations d’épuration Un développement trop important de bactéries filamenteuses conduit à des phénomènes de foisonnement qui affectent la décantation des boues. La qualité de l’effluent rejeté est dégradée. |
| Déversement de biodispersants dans les stations d’épuration En grande quantité, ces produits sont difficiles à éliminer et/ou à neutraliser. Leur rejet dans le milieu naturel peut causer des problèmes environnementaux. |
|
| Désinfection | Déversement de biocide dans les stations d’épuration Difficiles à éliminer totalement, des substances biocides sont rejetées dans le milieu naturel. causant également des problèmes environnementaux. |
| Résiduel dans les brouillards qui enveloppent la machine
Risque sanitaire (légionellose) pour les employés travaillant dans l’usine de fabrication. |
|
| Coût économique important en produit biocide pour l’entreprise |
Maîtriser l’utilisation des produits de traitement, c’est possible !
L’utilisation de produits de traitement reste indispensable, tant pour assurer une production de bonne qualité que pour garantir la sécurité des opérateurs et du client final. Cependant, il paraît nécessaire de maîtriser la quantité de produits utilisés pour limiter les rejets d’agents toxiques dans l’environnement.
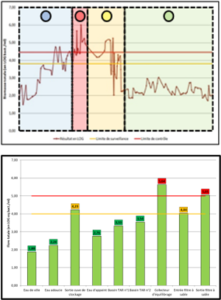
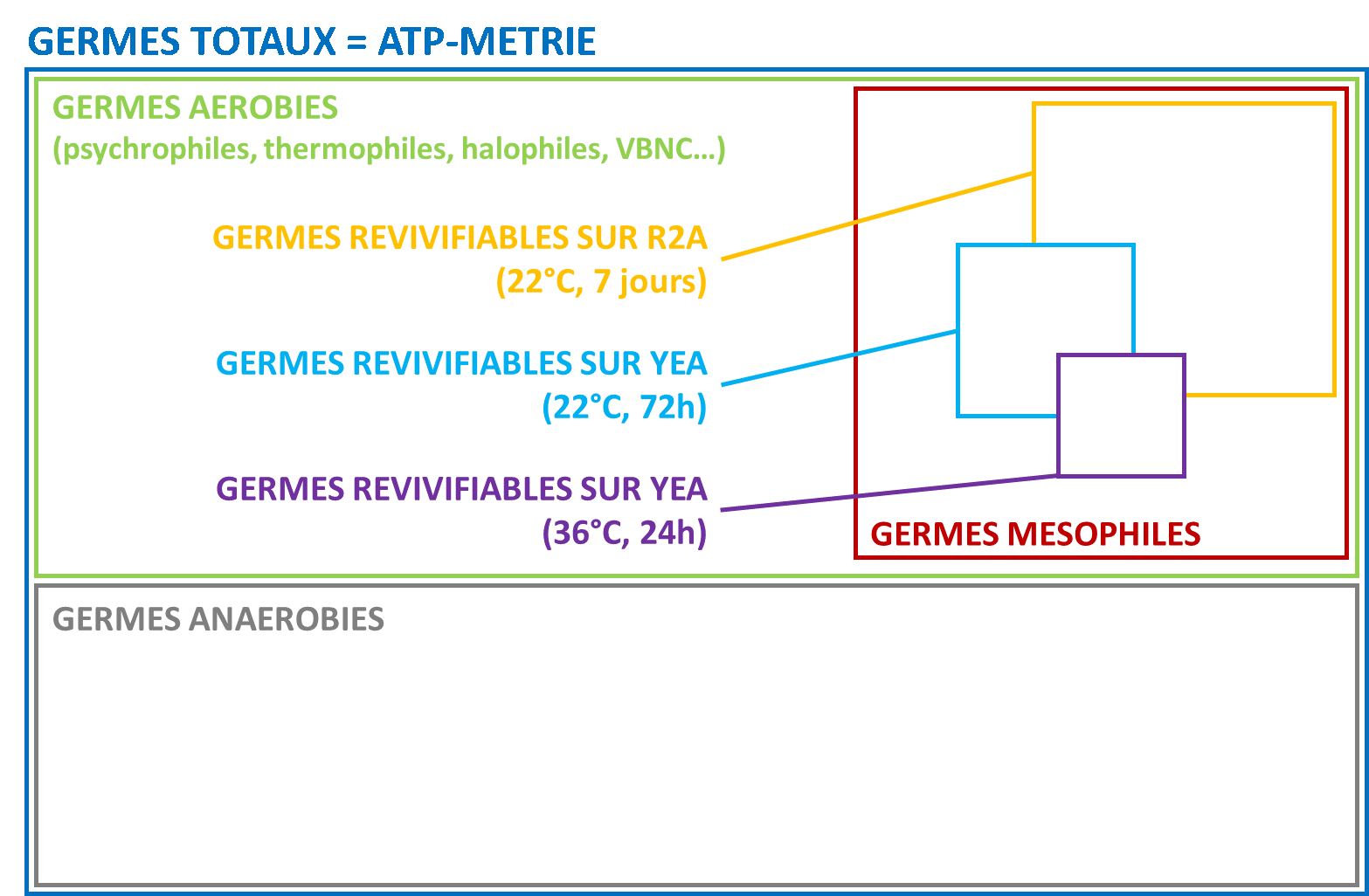
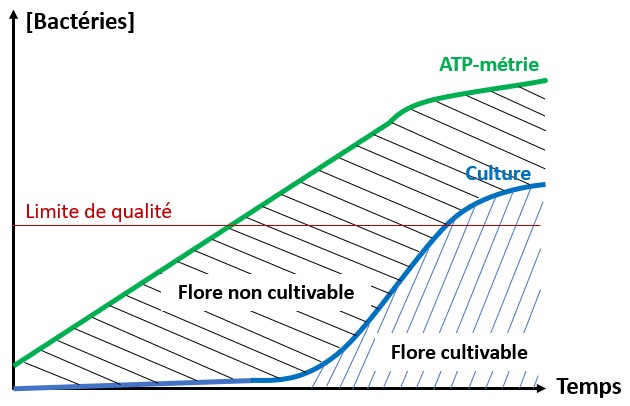
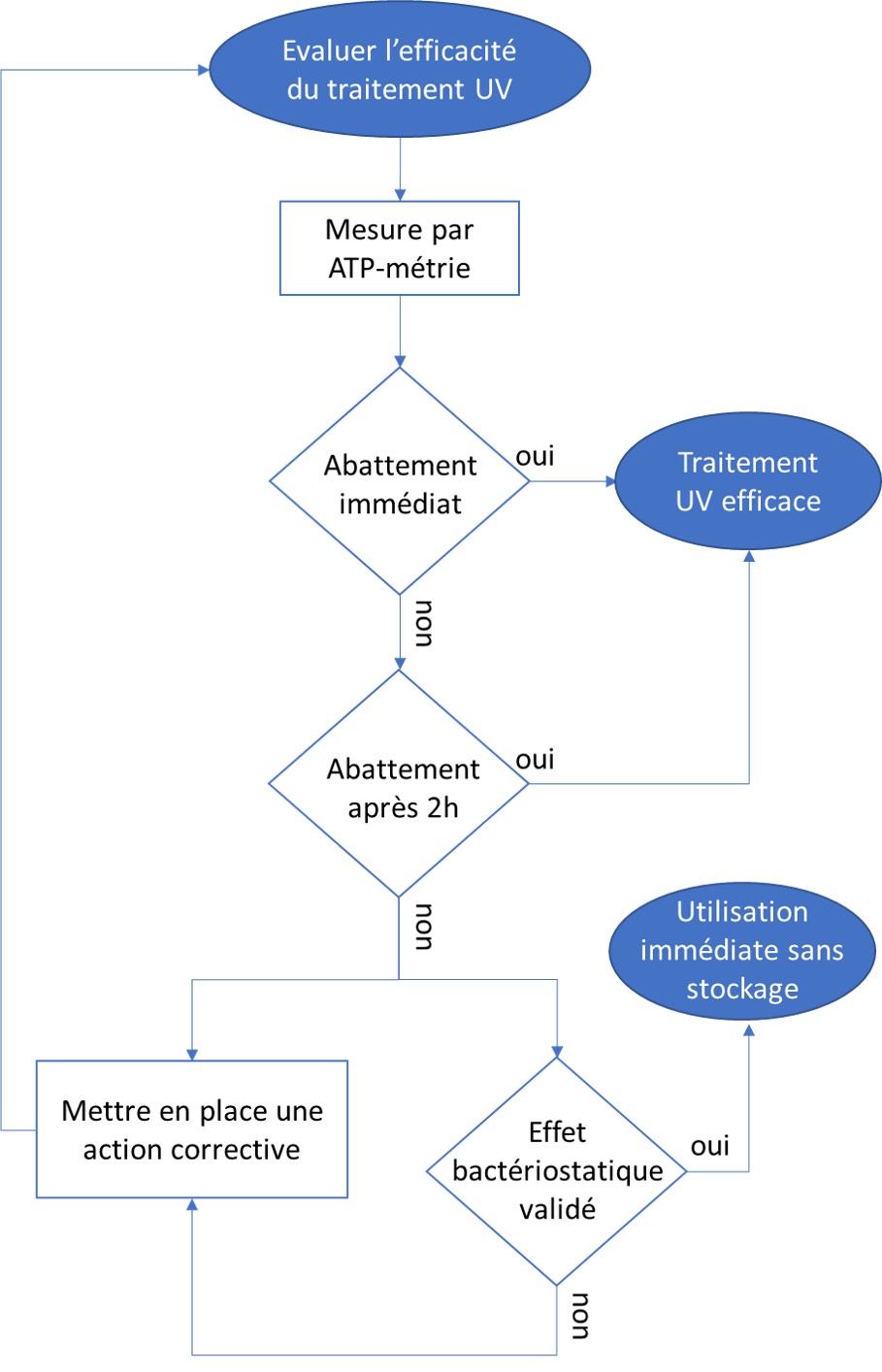
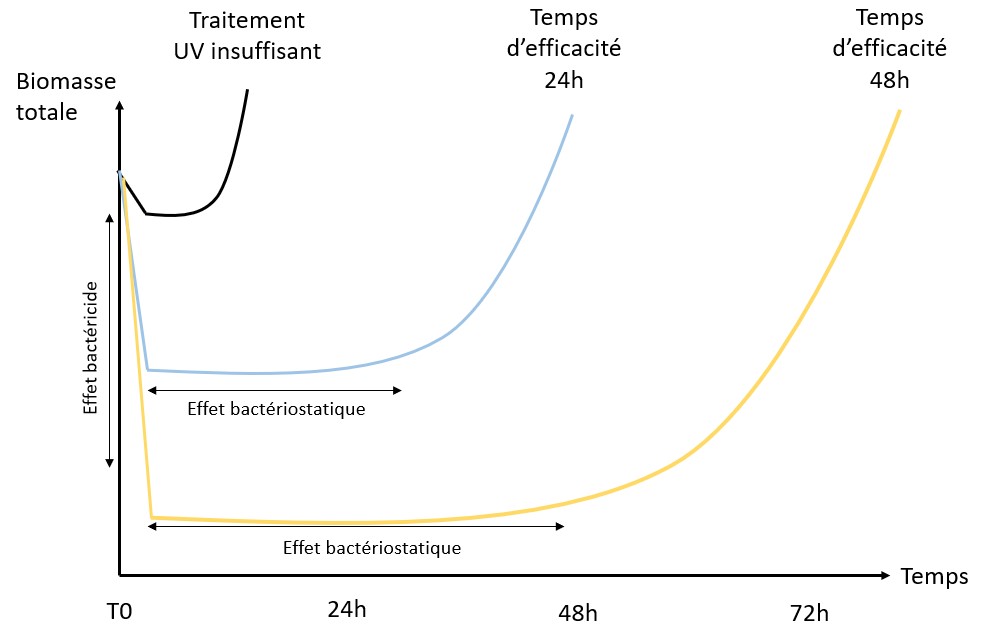
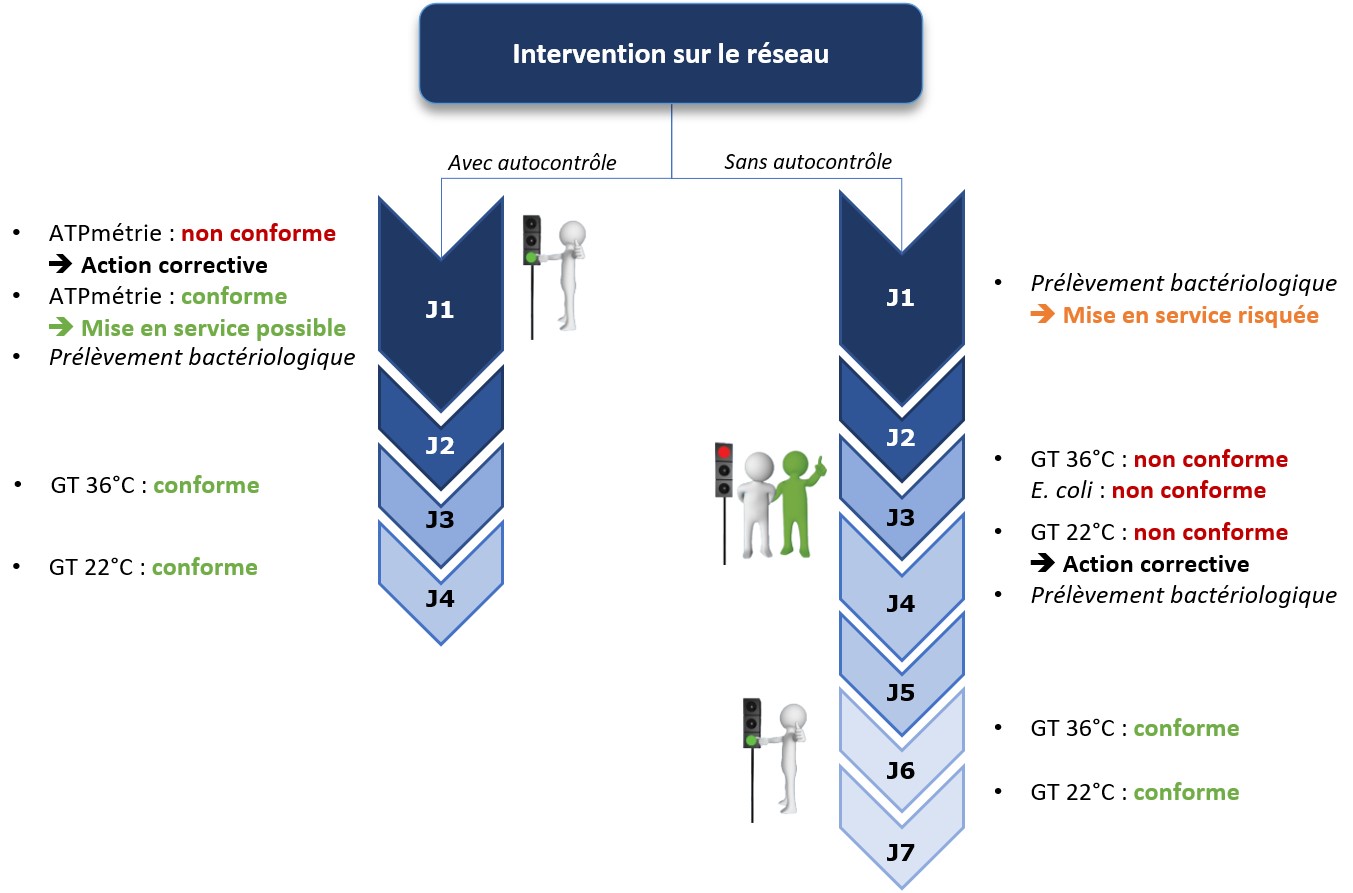
Une solution pour diminuer la quantité de produits est de prévenir les développements de biofilm en amont. En surveillant le réseau d’eau de manière régulière, l’exploitant peut anticiper les dérives microbiologiques et donc l’accumulation de biofilm et le relargage de celui-ci dans le produit. Dans ce cadre, disposer d’un indicateur de flore totale apparaît comme pertinent. L’ATP-métrie quantitative donne en 2 minutes sur le terrain le niveau de charge microbiologique globale d’une eau. Elle offre donc à l’exploitant la possibilité d’agir avant l’apparition de défauts sur le produit fini.
L’ATP-métrie permet entre autres :
- d’identifier des éléments du process sources de contamination ou de développement de micro-organismes pour mieux cibler les traitements antimicrobiens,
- d’évaluer l’efficacité des traitements biocides déjà en place,
- d’améliorer l’efficacité des traitements par un meilleur choix de la molécule active, des points et des fréquences d’injection,
- d’anticiper une dérive microbiologique.
L’ATP-métrie apporte donc de nombreux avantages :
- Diminution des défauts de production.
- Diminution des arrêts d’installation.
- Limitation de l’usage de produits toxiques pour l’environnement pour une gestion écoresponsable des produits biocides et biodispesants : n’injectez que ce dont vous avez besoin !
- Economies en produit de traitement.