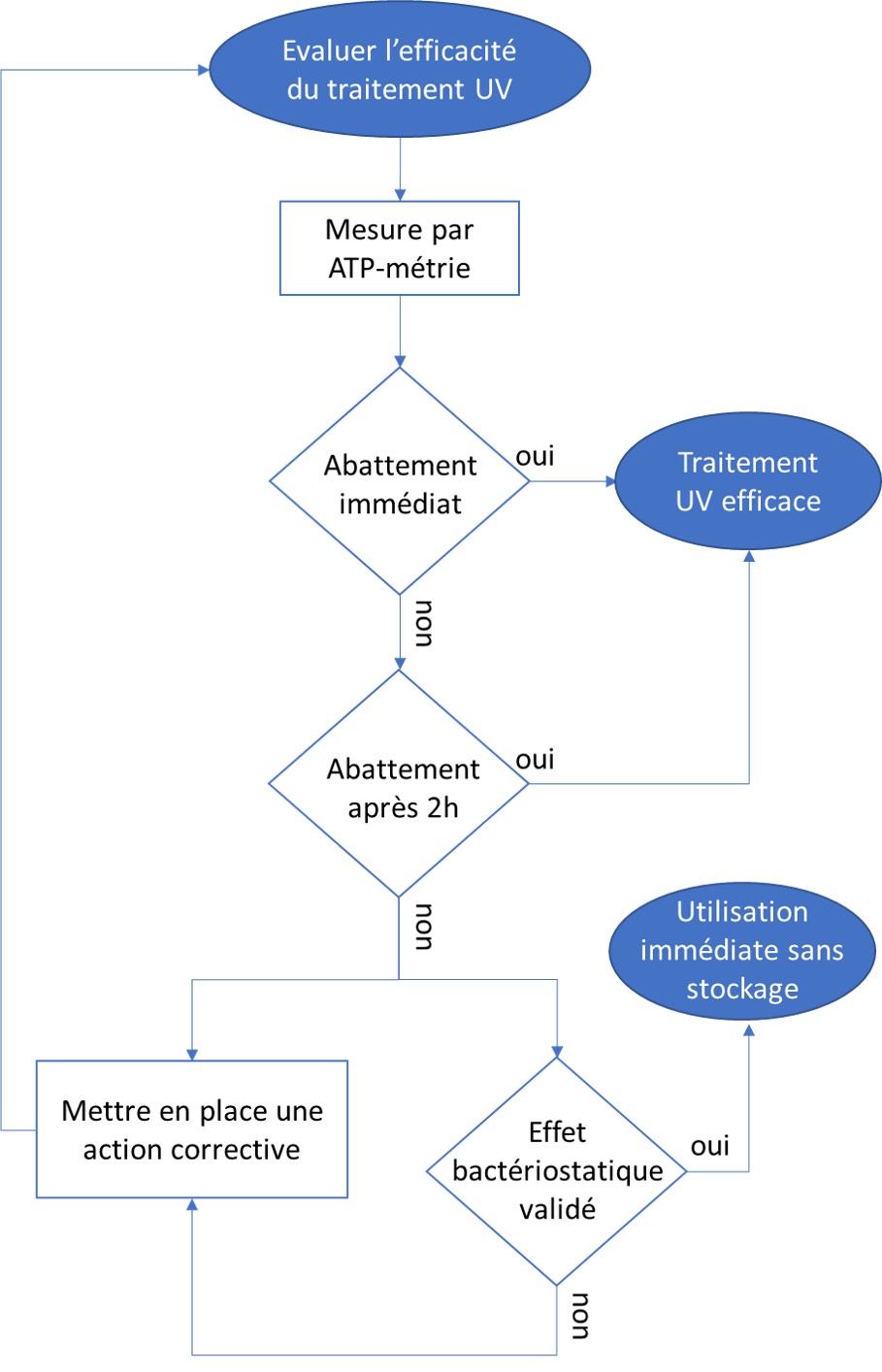
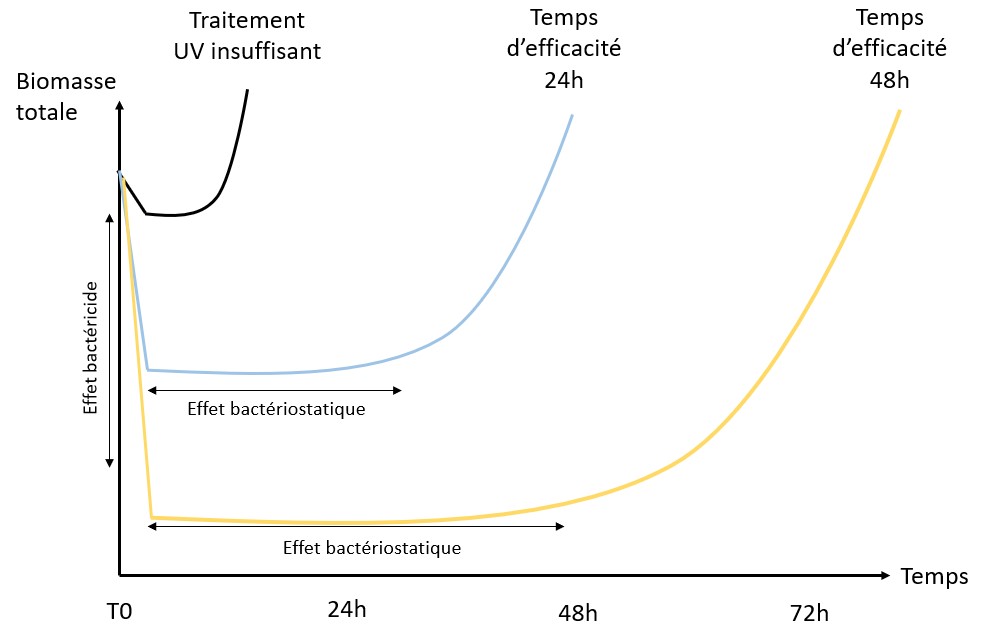
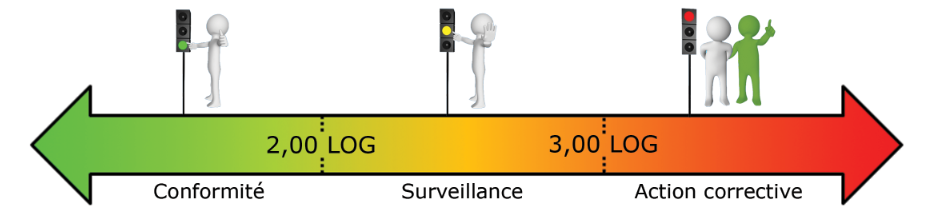
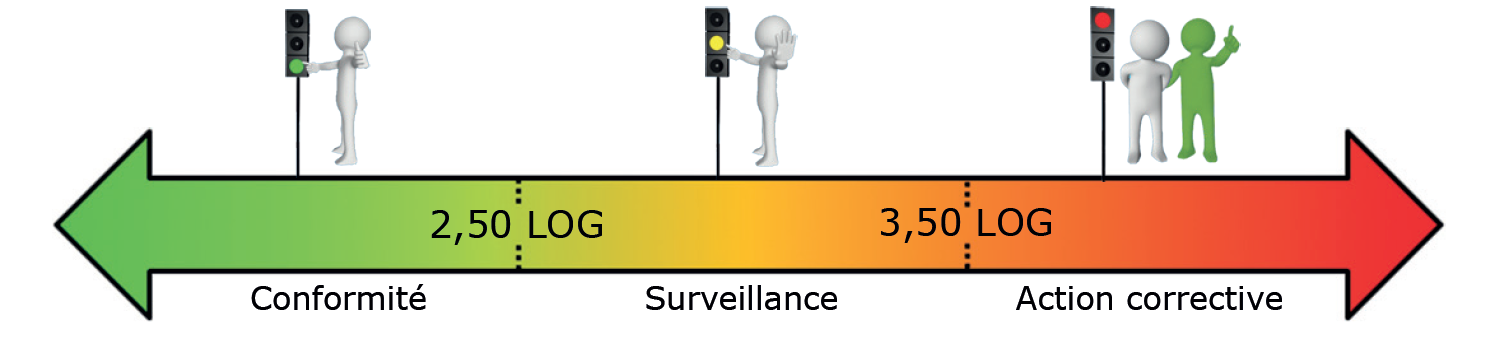
Détection des bactéries par
ATP-métrie, 40 ans d’évolution
Qu’est-ce que l’ATP ?
L’adénosine triphosphate (ATP) est une molécule utilisée chez tous les organismes vivants pour fournir de l’énergie aux réactions métaboliques. C’est le carburant des cellules. L’ATP étant spécifique des milieux vivants, on considère donc que toute trace d’ATP est le témoin d’une trace de vie.
L’ATP-métrie est une technique permettant de détecter la présence d’ATP dans un échantillon en quelques minutes seulement.
On trouve l’ATP sous deux formes :
- l’ATP libre ou extracellulaire,
- l’ATP intracellulaire.

L’ATP libre
Il s’agit de l’ATP libérée par les cellules mortes ou en phase de lyse. Lorsqu’une cellule meurt, elle perd son intégrité membranaire. L’ATP, molécule de très petite taille, est immédiatement relarguée dans le milieu.
N’étant pas très stable sous forme libre, elle est généralement dégradée en quelques heures. Sa stabilité est fonction de nombreux paramètres :
- Le pH : l’ATP libre est stable à pH neutre mais sa vitesse de dégradation augmente rapidement à des pH acide ou basique.
- La température : la vitesse de dégradation augmente avec la température. Plutôt stable à 4°C, elle se dégrade plus rapidement à 25-30°C.
- La présence d’agents stabilisant : tels que les polycations et/ou certains cations.
- Le type de biocide utilisé : les agents oxydants tels que le chlore ou le brome dégradent rapidement l’ATP libre alors que les agents non oxydants ont peu d’effet.
- La présence d’autres microorganismes : certains sont capables de récupérer l’ATP libre pour l’utiliser.
La stabilité de l’ATP libre dans un milieu est donc difficile à prévoir car elle dépend d’une combinaison de ces différents facteurs. En effet, si le milieu permet une bonne stabilité de la molécule d’ATP libre il y aura un phénomène d’accumulation. En revanche, si l’environnement est défavorable, l’ATP libre disparaîtra très rapidement.
L’ATP intracellulaire
Il s’agit de l’ATP présent dans les cellules vivantes. Comme évoqué précédemment, cette molécule joue le rôle d’intermédiaire énergétique indispensable à la cellule. C’est une molécule recyclée en permanence dans la cellule, mais sa production s’arrête immédiatement à la mort de la cellule.
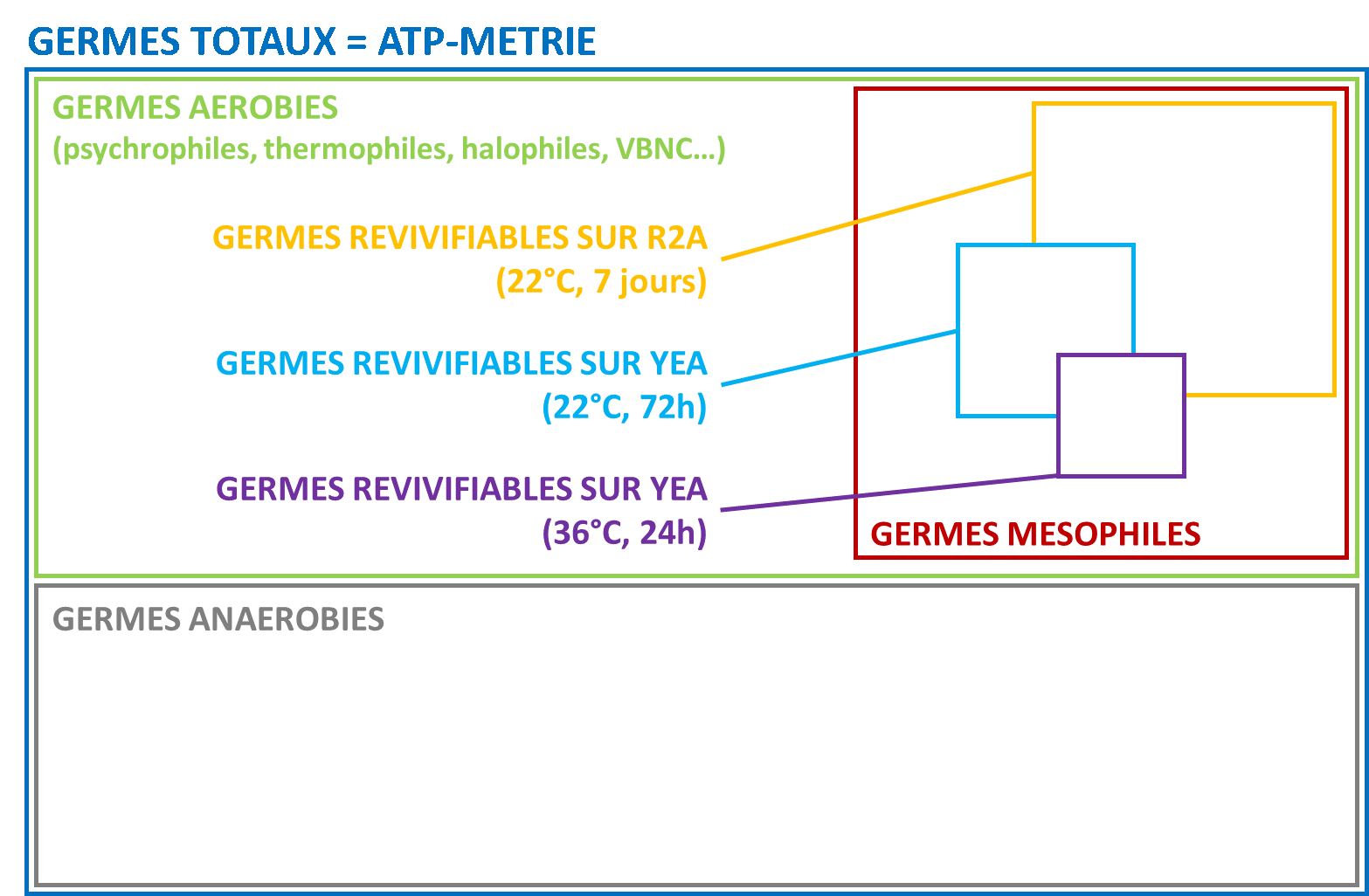
L’ATP totale correspond à l’addition de l’ATP intracellulaire et de l’ATP libre. Pour le mesurer, on utilise des agents de lyse qui vont détruire les cellules et extraire l’ATP. La mesure se fait alors sur l’ATP intracellulaire libéré et l’ATP libre.
Pour évaluer la quantité de microorganismes présents dans un échantillon, il nous faut donc mesurer seulement l’ATP intracellulaire.
“ATP totale – ATP libre = ATP intracellulaire”
Une approche risquée…
Comment mesurer l’ATP intracellulaire ?
Afin de la quantifier, deux techniques ont été développées : une mesure indirecte et une mesure directe.
La mesure indirecte :
La première technique ayant été développée est la mesure indirecte de l’ATP intracellulaire. On se base sur le postulat :
ATP totale – ATP libre = ATP intracellulaire
On mesure donc l’ATP totale et l’ATP libre pour en déduire l’ATP intracellulaire.
- Mesure de l’ATP libre : elle est mesurée par bioluminescence en absence d’agent lytique. Ainsi, seule l’ATP extracellulaire est disponible pour la réaction de bioluminescence. Cependant, comme on l’a décrit précédemment, la quantité d’ATP libre dans un milieu peut être très variable et dépend de nombreux facteurs. Elle n’est pas représentative de la quantité de micro-organismes dans l’échantillon. Il y a, de ce fait, une forte incertitude de mesure sur l’ATP libre.
- Mesure de l’ATP totale : elle est mesurée par bioluminescence en présence d’agents lytiques qui détruisent les cellules. L’ATP intracellulaire est libérée et se cumule alors à l’ATP libre pour la réaction de bioluminescence. Les volumes d’échantillon étant généralement faibles (environ 100 µl), la présence de fragments de biofilm peut fortement modifier le résultat.
Ainsi, avec cette stratégie, la mesure de l’ATP intracellulaire repose sur la soustraction de deux mesures incertaines, ce qui rend le résultat approximatif, voire erroné.
L’autre problème réside dans le caractère relatif de la mesure d’ATP libre ou totale. En effet, le résultat rendu par le luminomètre est en Unité Relative de Lumière (RLU). Or, dans cette approche indirecte, il n’y a pas de standardisation de la mesure. Elle est donc dépendante de nombreux facteurs agissant sur l’efficacité de l’enzyme (température, âge de l’enzyme, effet des agents de lyse, des biocides…).
Le fait de travailler sur des mesures seulement qualitatives entraîne de grandes approximations. Il arrive même d’obtenir une quantité d’ATP libre supérieure à l’ATP totale pour certains échantillons !
En conclusion, la mesure de l’ATP intracellulaire par cette approche est une méthode simple et rapide. Cependant, de par les problématiques évoquées ci-dessus, entrainant de fortes variabilités, le résultat peut s’avérer très difficile à interpréter. Il doit donc être pris avec précaution pour éviter les surinterprétations.
Mesure de l’ATP intracellulaire directe
Pour mesurer directement l’ATP intracellulaire, il faut ajouter une étape de filtration sur membrane qui permet d’éliminer l’ATP libre. En effet, cette molécule étant très petite, elle n’est pas retenue sur le filtre alors que les microorganismes intacts le sont.
La stratégie consiste ensuite à lyser les microorganismes retenus sur le filtre afin de libérer l’ATP intracellulaire. On a alors une vision représentative des organismes vivants présents dans l’échantillon.
Par ailleurs, cette stratégie a aussi l’avantage de travailler sur un volume représentatif d’eau, entre 10 et 50 ml en général.
Bien que nécessitant un peu plus de manipulation, cette approche, couplée à une standardisation, permet d’avoir une analyse quantitative bien plus robuste et facilement comparable dans l’espace et dans le temps.
Conclusion
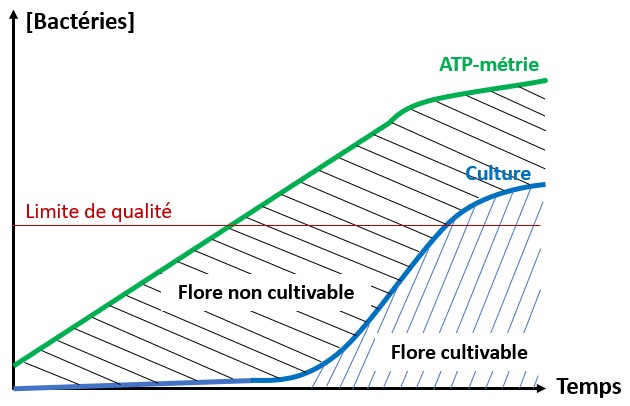
L’ATP-métrie est une des méthodes les plus rapides et simples pour détecter la présence de microorganismes dans un échantillon d’eau. Cette analyse, vieille de 40 ans, a bien évidemment évolué au cours du temps.
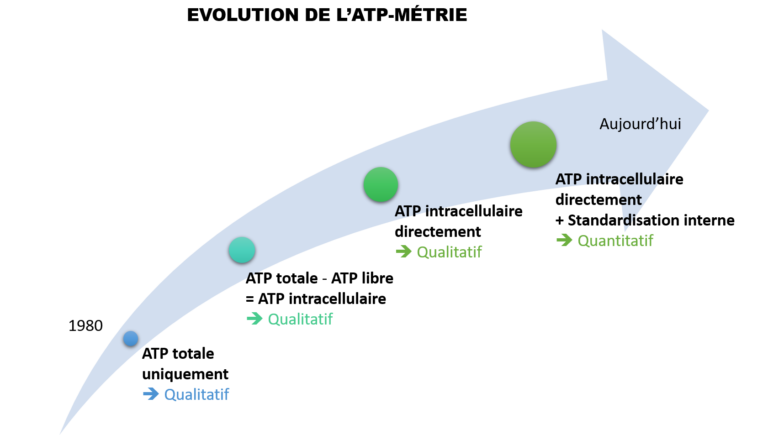
Au départ, seule l’ATP totale était détectée de manière qualitative. Puis, grâce à la mesure de l’ATP libre, il a été possible d’évaluer l’origine intracellulaire ou non de cette ATP et donc de détecter les « microorganismes vivants ». Cependant, dû aux fortes variabilités, l’interprétation des résultats restait souvent compliquée. Puis, il y a 15 ans, les approches par filtration ont permis de réellement s’affranchir des problèmes liés à l’ATP libre pour n’analyser que l’ATP intracellulaire. Enfin, l’arrivée de la standardisation externe puis interne a permis de rendre cette mesure quantitative, et donc robuste et comparable dans le temps et ou dans l’espace donnant toute sa pertinence à l’ATP-métrie.