Contexte
En décembre 2019, 24 cas de légionelloses ont été détectés dans l’ouest de Strasbourg causant 2 décès. Selon les résultats de l’enquête, le condenseur par voie humide d’une chaufferie collective serait à l’origine de ces contaminations.
Selon leur mode de fonctionnement et ainsi que leur conception, les installations de récupération de chaleur par dispersion d’eau dans les fumées peuvent présenter un risque de prolifération des légionelles et leur dispersion dans l’environnement.

Afin de prendre en compte le risque Legionella lié à l’exploitation de ces installations, le ministère a décidé d’intégrer ces équipements à la rubrique 2921 des ICPE au même titre que les tours aéroréfrigérantes. L’arrêté du 23 juillet 2021 brosse le portrait des évolutions réglementaires et leur application.
A partir du 1er septembre 2021 et progressivement jusqu’en janvier 2025, l’arrêté du 14 décembre 2013 relatif aux installations soumises à déclaration sous contrôle s’appliquera aux condenseurs par voie humide.
Quelles mesures devront être mises en place ?
Concrètement, qu’est-ce que cela implique pour les exploitants de telles installations ?
Nous vous dressons ici une liste non exhaustive des principales actions à mettre en œuvre :
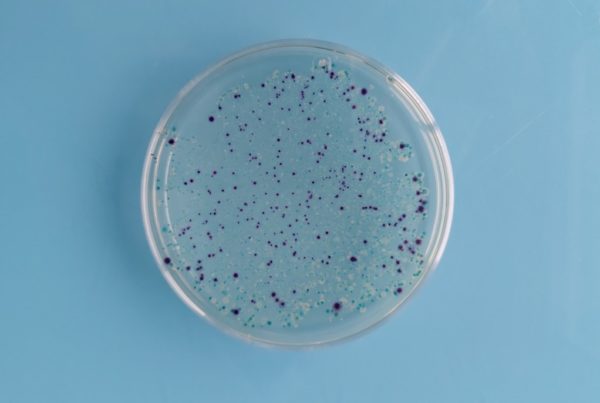
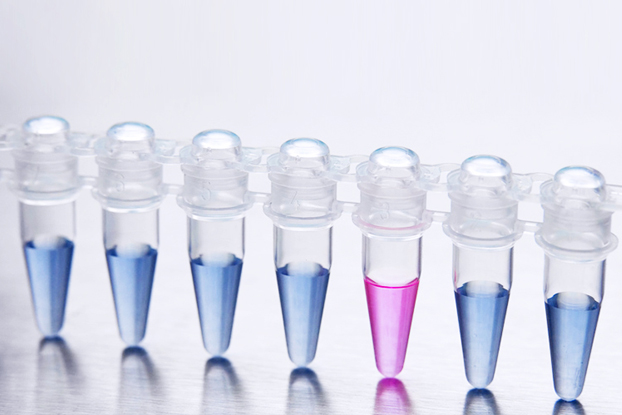
- Suivi bimestriel de la concentration en Legionella pneumophila par un laboratoire accrédité COFRAC selon la norme NF T90-431. Le seuil limite se situe à 1000 UFC/l.
- Mise en place d’une AMR (Analyse Méthodique des Risques) qui devra être reconduite tous les deux ans sur l’installation. L’AMR a pour but d’identifier tous les facteurs de risques de prolifération ou de dissémination des légionelles.
- Formation de l’ensemble du personnel intervenant à la gestion des risques « Legionella ».
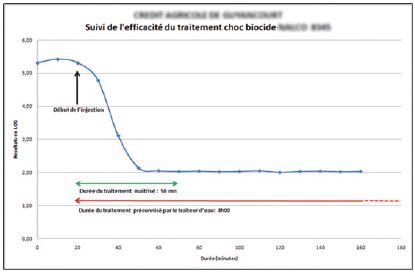
- Mise en place d’une stratégie de traitement chimique ou physique pour lutter contre l’entartrage, la corrosion, le développement bactérien et de biofilm.
- Formalisation d’un plan d’entretien de maintenance et de surveillance de l’installation. Ils intègrent toutes les mesures préventives visant à minimiser les risques.
- Formalisation de l’ensemble des procédures de réaction face à un résultat positif en légionelles ou en cas de flore interférente.
- Mise en place d’un carnet sanitaire qui rassemble les procédures et toutes les données de traçabilité liées à la gestion de l’installation.
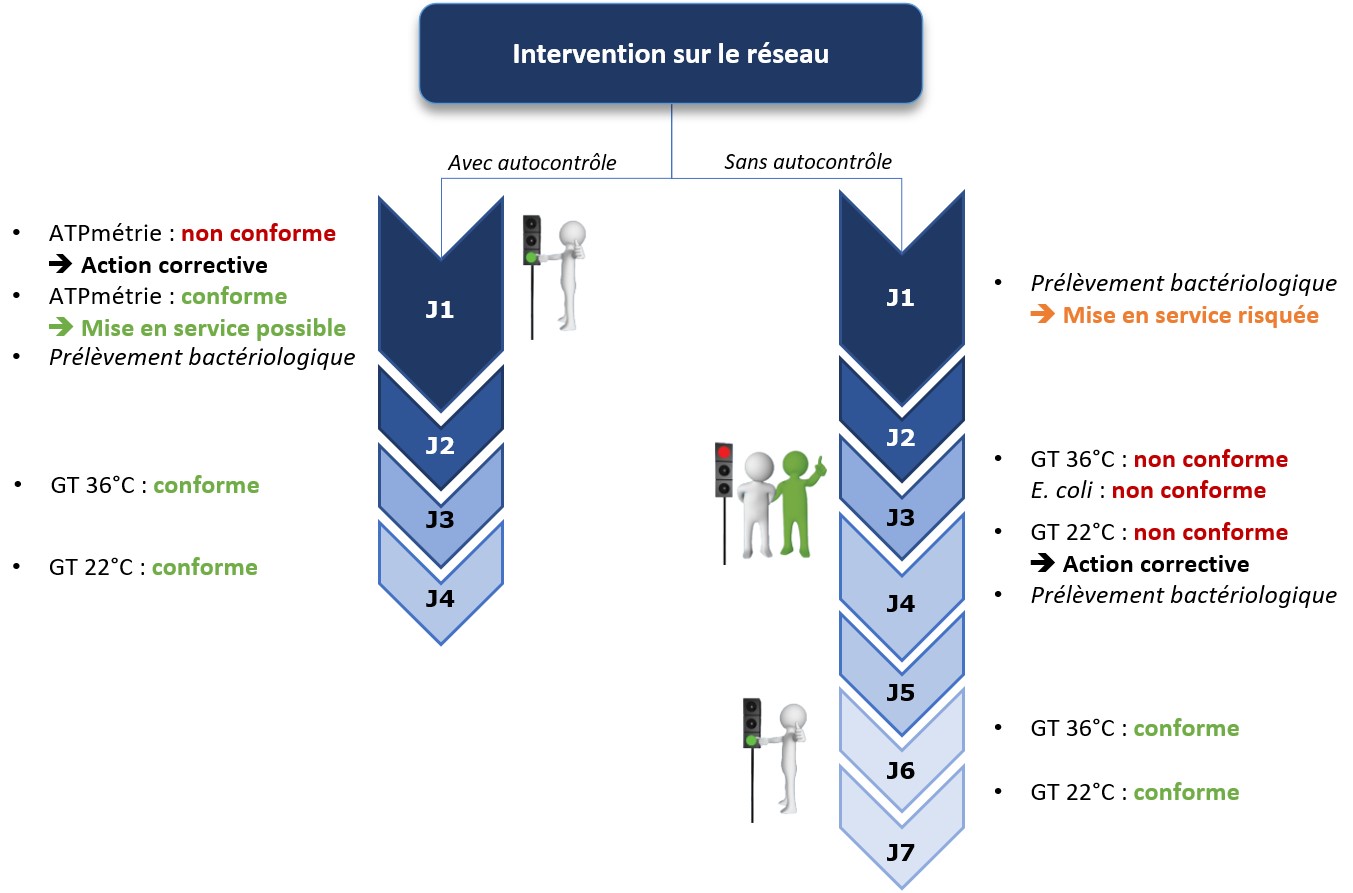
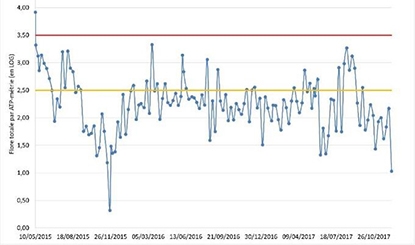
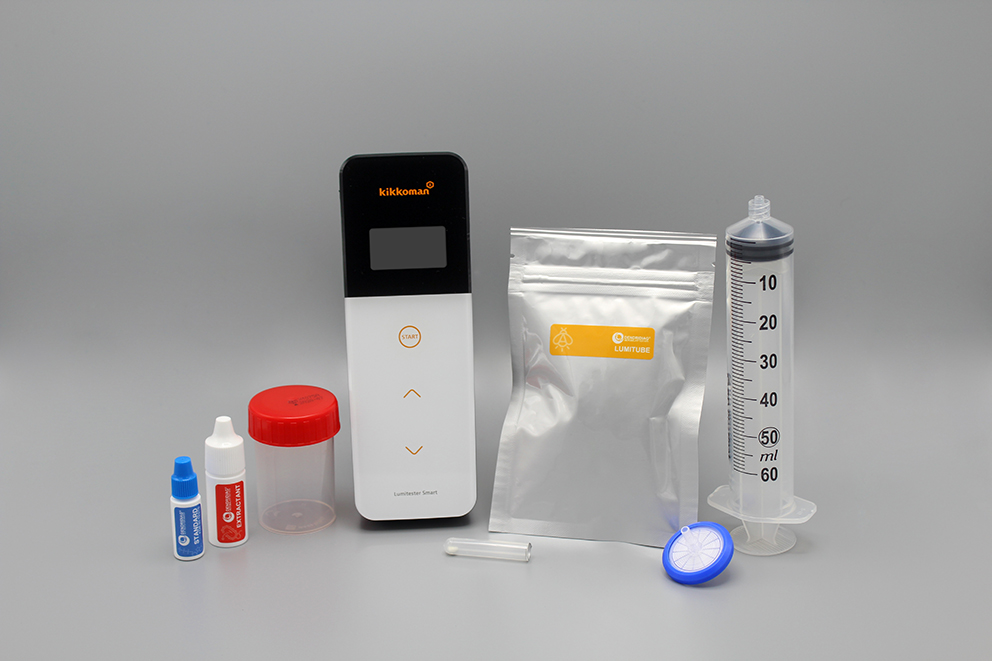
- Mise en place d’un indicateur microbiologique pour anticiper une dérive de l’installation tel que l’ATP-métrie.
L’entrée dans la rubrique 2921 des installations de récupération de chaleur par dispersion d’eau dans les fumées n’est pas anodine. Elle engendre des coûts de main d’œuvre, d’exploitation, d’analyses et de produits de traitement importants pour l’exploitant.